清华刘冬生/ASU颜颢/首都医大桂松柏:高渗透性
[Abstract]
哺乳动物严重脊髓损伤后无法再生它自然发生。将干细胞移植到损伤部位是一种很有前途的方法,但它面临许多挑战,因为它严重依赖于损伤部位和递送材料提供的微环境。尽管已经广泛探索了递送材料的机械性能、生物相容性和生物降解性,但很少认识到它们的渗透性。近期,清华大学刘东升教授、 亚利桑那州立大学闫郝教授, 首都医科大学桂松柏主任医师/教授团队合作 设计一种具有极高渗透性的 DNA 水凝胶,用于修复 Sprague-Dawley 大鼠的 2 mm 脊髓间隙。

< span>大鼠通过可检测的运动诱发电位恢复基本的后肢功能,并通过植入和内源性干细胞增殖分化形成新的神经网络强><跨度>。来自患病区域的信号平均由 15 个新形成的突触传递。这种水凝胶系统在临床试验中具有巨大的潜力。此外,它应该很容易适应其他组织再生应用。相关论文标题为高渗透性DNA超分子水凝胶促进完全横断脊髓损伤后的神经发生和功能恢复 < span> 发表于“Advanced Materials”。
[主要图片指南]
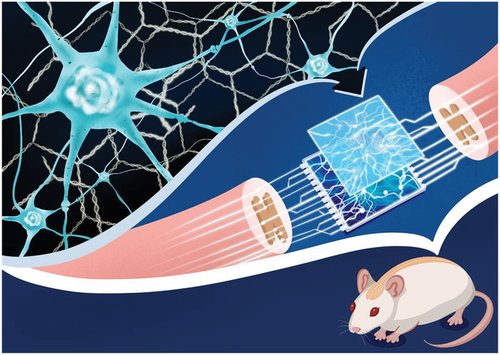
图 1 DNA 超分子水凝胶在损伤部位支持新生神经网络形成。 高渗透性超分子DNA水凝胶携带同源神经干细胞,用于修复大鼠2毫米长的脊髓间隙。新生神经网络是通过植入和内源性干细胞的增殖和分化在病变部位形成的。病变区域的信号由新形成的突触传递。
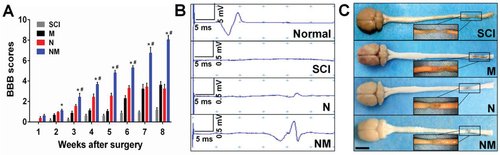
图2 体内功能恢复研究。 A) 术后每周四组的野外运动-BBB后肢评分。 B) 手术后八周,正常 SD 大鼠和三个实验组的代表性运动诱发电位 (MEP) 痕迹。 C) 所有实验组术后 8 周的中枢神经系统标本。
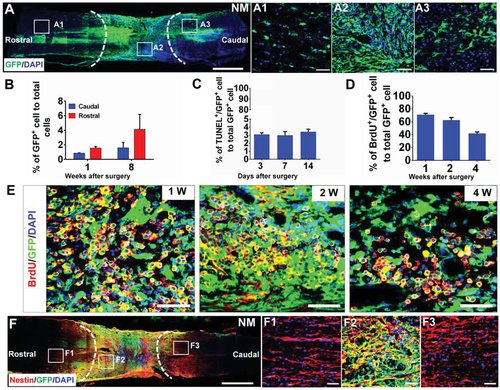
图 3 接受携带 NSC 的 DNA 水凝胶的 NM 组中 NSC 的存活、迁移和增殖。
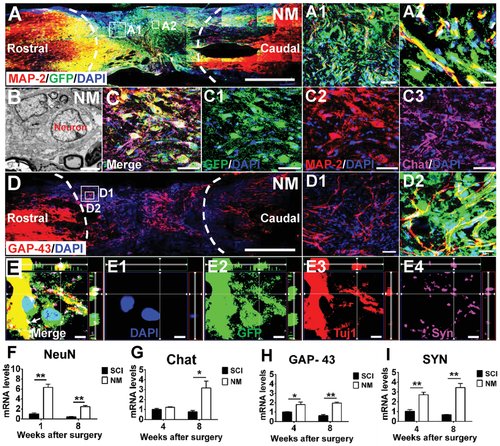
< strong>图 4 接受携带 NSC 的 DNA 水凝胶的 NM 组中的新生神经元、轴突和突触。
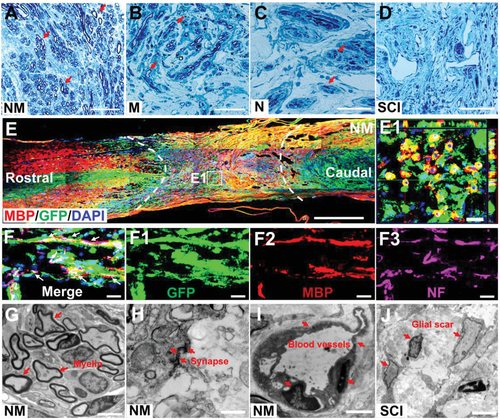
< strong>图 5 髓鞘再生。 A-D) 移植后 8 周,NM、M、N 和 SCI 组病灶中间半薄切片的阴性染色。 E) 移植后 8 周脊髓的矢状视图 (MBP/GFP/DAPI 免疫标记)。 F) 病变部位的有髓轴突 (GFP/MBP/NF 免疫标记)。比例尺:20 μm。 G-I) 移植后 8 周 NM 组病灶中部再生髓鞘、突触和血管的 TEM 图像。 J) 移植后 8 周 SCI 组病变处胶质瘢痕形成的 TEM 图像。比例尺:5 μm。
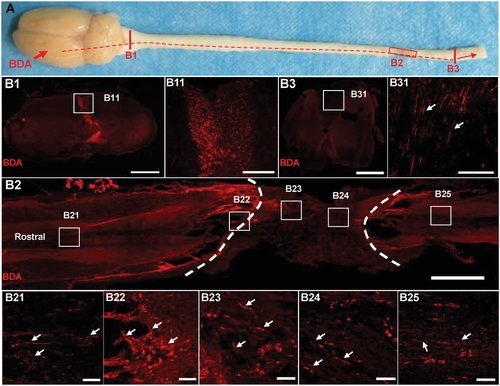
图6 修复脊髓神经传导机制。 A) 在中枢神经系统样本中使用顺行跟踪的采样点图像。损伤后 8 周将 BDA 注入双侧运动皮层。 B1) 注射后 2 周,NM 组(接受携带 NSC 的 DNA 水凝胶)通过 BDA 免疫染色对脑干横截面的概述。比例尺:1000 μm。 B11) 来自 (B1) 的放大图像。比例尺:100 μm。 B2) 注射后两周,NM 组脊髓的 BDA 免疫染色矢状切面。比例尺:1000 μm。 B21–B25) (B2) 不同部位的放大图像。比例尺:50 μm。 B3) 注射后 2 周,通过 BDA 免疫染色观察尾宿主脊髓的横截面,NM 组。比例尺:1000 μm。
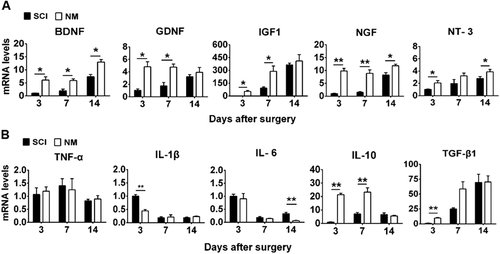
图7 只有损伤(SCI)组和NM组(接受携带NSC的DNA水凝胶)修复了脊髓组织微环境中mRNA水平随时间的变化。 A) 神经营养因子和 B) 炎症细胞因子。
[总结]
< span>这种设计合理的超分子DNA水凝胶具有聚合物渗透性,可有效携带同源神经干细胞修复SD大鼠2毫米脊髓缺损。 8周后,基本后肢功能恢复,可检测到MEP信号。通过植入的干细胞和内源性干细胞的增殖和分化,在病灶内形成新的神经网络。这个新生网络通过新形成的突触支持患病区域的信号传输。
